Historique et contexte de la corrosion galvanique en marine :
Le phénomène de corrosion galvanique doit son nom à Luigi Galvani qui l’a découvert en 1791, phénomène expliqué par Volta en 1800.
La corrosion galvanique existe spontanément dès que quatre conditions sont réunies :
- Un électrolyte : c’est-à-dire une solution liquide, légèrement conductrice de l’électricité. Pour nous c’est l’eau de mer (conductivité environ 50,000 μS/cm).
- Un métal « noble ».
- Un métal différent du premier, moins « noble ».
- Et un contact électrique entre les deux métaux.

Les métaux ou alliages sont en effet caractérisés par leur différence de potentiel galvanique, voir sur l’échelle ci-contre.
Les différences de potentiel indiqués sont conventionnellement référencés par rapport à une électrode de référence dite électrode au calomel saturée dont le potentiel est +0,2444 V par rapport à l’électrode à hydrogène qui constitue la vraie référence internationale.
A noter le comportement particulier de certains alliages comme les aciers inox, qui peuvent être :
- passifs si le revêtement protecteur d’oxyde est présent (cas normal dans l’eau de mer du fait de l’oxygène dissous)
- actifs si privés d’oxygène (par exemple au niveau des zones de contacts des paliers caoutchouc avec les arbres d’hélice).
Cette forme de corrosion concerne donc tous les éléments métalliques des œuvres vives du bateau, soit pour les bateaux en bois ou en verre-résine les passe-coques, quille, boulons de quille, arbre d’hélice, chaises d’arbre, hélices, mèches de gouvernail. Pour les bateaux métalliques, l’ensemble de la structure est concerné.
Ne pas oublier que le phénomène peut aussi exister à l’intérieur du bateau, notamment dans les fonds si de l’eau de mer est présente. En particulier, des problèmes importants peuvent se produire entre un lest encapsulé et la structure de la quille ou de la coque métallique.
Le phénomène existe aussi hors de l’eau, par exemple pour le gréement et l’accastillage, l’air salin joint à l’humidité de l’air ambiant suffisant à créer les conditions de la corrosion entre éléments en métaux différents.
Ce phénomène de corrosion existe en dehors de toute installation électrique sur le bateau : il a été découvert au XVIIIème siècle lorsque des bateaux à carène doublée en cuivre contre les salissures et les tarets ont commencé à perdre leur safran par corrosion des fémelots en fer…
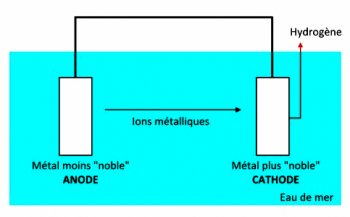
Si l’on établit une liaison électrique (fil conducteur) entre les deux métaux, au sein de l’électrolyte se produit un transport de matière du métal le moins « noble », qui est appelé l’anode, vers le métal plus « noble », qui est appelé cathode. Ce transport de matière se fait sous forme de transfert d’ions métalliques : l’anode se corrode, elle se « consomme ». Dans le conducteur reliant les parties métalliques, la circulation des électrons produit un courant électrique. Côté cathode, les électrons qui arrivent par le conducteur se combinent aux anions H+ de l’eau de mer pour donner de l’hydrogène H2 qui se dégage.
On a formé une pile !
On admet que ce phénomène de corrosion n’est significatif que s’il existe une différence de potentiel de 100 à 200 mV (millivolt) entre les deux métaux.
Un exemple sur nos bateaux :
Si on considère le montage classique d’une hélice en bronze d’aluminium (potentiel de référence : - 400 mV) sur un arbre en inox 316 passif (potentiel de référence : -50 mV), nous constatons que la différence de potentiel serait de 350 mV environ, ce qui va se traduire par une corrosion rapide de l’hélice si aucune précaution n’est prise.
Protection par conception :
Afin de limiter les effets de la corrosion galvanique, il faut :
- Choisir des compositions pour les métaux en contact aussi proches que possibles dans le tableau des potentiels galvaniques.
- Isoler électriquement autant que possible pratiquement les métaux différents (canons plastique, mastic type Mastinox). Peindre les assemblages (avec une peinture galvaniquement compatible) peut aider.
- Eviter les liaisons vissées qui vont se dégrader rapidement en cas d’utilisation de matériaux éloignés dans l’échelle galvanique, . Préférer si possible le brasage avec une brasure moins « noble » qu’au moins un des deux matériaux.
- Eviter des combinaisons où la surface en contact avec l’électrolyte du matériau le moins noble est plus faible que celle du matériau le plus noble.
- Appliquer les revêtements avec discernement : ne pas peindre le matériau le moins « noble » sans peindre aussi le plus « noble », sinon l’attaque se concentrera sur les défauts dans le revêtement du matériau le moins noble. Bien entretenir les revêtements.
- Attention aux charges et pigments métalliques des peintures qui peuvent réagir sur le substrat (en particulier antifouling contenant du cuivre sur coque ou embase aluminium !).
- Des passe-coques et des vannes en composite (Randex, Marelon) ou en Delrin (pas de PVC dangereux car trop fragile) suppriment bien des soucis..
- Proscrire le graphite (lubrifiant mais aussi crayon !) et les graisses graphitées ! (Voir la position du graphite sur le tableau).
- Enfin, attention aux matériaux à base de fibre de carbone, très actifs même s’ils ne sont pas à proprement parler métalliques, s’ils ne sont pas protégés par au moins un pli de tissu de verre/époxy.
Pour protéger un élément métallique, on peut le relier électriquement à un élément en un matériau moins noble, qui sera « sacrifié » en se corrodant à la place de l’élément que nous voulons protéger.
Cette protection peut être étendue à tous les éléments que l’on souhaite en les reliant entre eux suivant le schéma ci-contre : par exemple une anode en zinc montée sur l’arbre d’hélice protègera par exemple à la fois l’arbre et l’hélice puisque le zinc est moins « noble » que ces deux matériaux.
Efficacité de la protection :
Cette protection sera efficace tant qu’il reste suffisamment de matériau à l’anode pour générer le courant de protection. Ce courant est proportionnel à la surface active en contact avec le l’eau de mer et les anodes devront donc être correctement dimensionnées en taille et nombre pour assurer la protection entre deux mises au sec pour remplacement.
Attention, la protection suppose aussi que le métal de l’anode soit adapté. Il existe des normes pour la composition des anodes (EN 1179, ASTM b418-09, MIL-A-18001K). Il convient de vérifier la conformité des anodes à une de ces normes (elles sont équivalentes) : il semblerait en effet qu’existent sur le marché des anodes « àpascher » à la composition aussi douteuse que l’efficacité.
Le risque de surprotection :
Il faut noter que la protection par anodes sacrificielles peut entraîner deux types de désordre :
- Sur les bateaux en bois, la surprotection (au-delà de -550 mV) des éléments métalliques, notamment des passe-coques, peut entraîner une grave dégradation du bois environnant ces éléments (dégradation de la lignine par l’hydroxyde de sodium généré). Il semble préférable dans ce cas de ne pas relier les éléments type passe-coque par une liaison de masse commune, contrairement à la norme ABYC américaine, et de se contenter de protéger localement les arbres d’hélices et le lest de quille et ses boulons.
- Sur les bateaux métalliques, une protection au-delà de -1050 mV pour les bateaux en aluminium et -1200 mV pour les bateaux en acier entraînera un cloquage des revêtements et éventuellement des dégâts importants (attaque amphotèrique). La protection étant assurée dès -750 mV, il est inutile d’aller beaucoup au-delà. En particulier des anodes en magnésium peuvent entraîner facilement ce type de phénomène, contrairement au zinc (-1050 mV) : des anodes en magnésium ne doivent jamais être utilisées en eau de mer.
Nota :
La protection anodique est efficace, mais présente malgré tout des inconvénients : outre les risques liés à la surprotection, la protection anodique empêche l’oxydation superficielle des métaux à base de cuivre qui leur permettrait d’être naturellement résistants à la salissure (fouling) et semblerait même favoriser la croissance des organismes indésirables.
Des crevettiers ont été réalisés avec des coques en cupro-nickel 80/20, avec tous les éléments en œuvres vives en alliages cuivreux galvaniquement compatibles et vivent depuis des années sans anodes ni fouling en eaux tropicales…. Le rêve, mais il a son prix (élevé…).
En complément à cet article, on pourra lire sur le site :
La corrosion galvanique : 2- le bateau dans son environnement
La corrosion électrolytique par courant de fuite continu
La corrosion électrolytique par courant de fuite alternatif
Mesures de contrôle en protection galvanique


 Suivi RSS
Suivi RSS Conception
Conception


 Version imprimable
Version imprimable Publié Juillet 2011, (màj Juillet 2011) par :
Publié Juillet 2011, (màj Juillet 2011) par :